
Kanser Tedavisinde Güncel Tedaviler: CAR-T Hücre Tedavisi
Kanserle mücadele için yapılan çalışmalar, bir hastalık grubu çerçevesinin çok ötesinde, genel olarak hayatın tüm fizyolojik ve fizyo-patolojik süreçlerine ışık tutmaktadır. Kanser, biyolojik ve genetik nedenlerden kaynaklandığı gibi insanların yaşam koşullarıyla da ilgili bir hastalıktır. Yapılan araştırma sonuçlarına göre; barınma, çalışma, beslenme, kişisel hijyen ve öz bakım dahil olmak üzere yaşamın tüm alanlarında ortaya çıkan sorunlar kanser insidansını etkilemektedir. Dünyada her 5 kişiden biri yaşamı boyunca kansere yakalanırken, her 8 erkekten 1’i ve her 11 kadından 1’i kanser nedeniyle yaşamını kaybetmektedir. Dünya genelinde kanser sıklığının hızla artması günümüzde daha etkili tedavilere ihtiyacı da gündeme getirmektedir. Her gün yeni tedavilere uyandığımız dönem içerisinde bu tedavilerin etkinliğiyle birlikte sürdürülebilir olması da gereklidir. Bilgisayar veri tabanlarına dayanan bilgi işlem ve moleküler düzeydeki biyokimyasal simülasyon olanakları ile etken madde taramaları ve yeni ilaç tasarımları çok daha hızlı, daha ekonomik ve güvenilir şekilde yapılabilmektedir.
Kanser tedavisindeki yeni gelişmelerden biri de Kimerik Antijen Reseptör T hücresi (CAR-T) tedavileridir. CAR-T hücre tedavisinin amacı; T hücrelerini hastalardan almak, onları kanser öldürücü CAR-T hücrelerine dönüştürmek, sonra hastalara geri vermektir. CAR-T hücreleri, birçok hastalığa potansiyel tedavi sağlayan yeni bir terapötik sınıftır. Bugüne kadar CAR-T hücreleri tarafından tedavi edilen başarılı sonuçlar lenfositik lösemi ve lenfoma hastalarından elde edilmiştir. Tedavi ilerledikçe hematolojik olmayan kanserlerde de başarılı sonuçlar elde edilmeye başlanacağı öngörülmektedir. CAR’ların tasarımı yıllar içinde büyük ölçüde gelişmiştir. Etkinliği ve güvenliği daha da arttırmak için yeni özellikler dahil edilmelidir.
Birçok zorluğa ve kullanılan teknolojinin tam olarak mükemmelliğe ulaşmamış olmasına rağmen CAR-T hücreleri daha önce hiç şansı olmayan hastalara umut vermektedir. Hâlihazırda piyasadaki ilk tedavilerle, önümüzdeki birkaç yıl içinde daha fazla ve daha iyi alternatiflerin gelmesi için çabalanmaktadır.
KANSER NEDİR?
Tarih boyunca kanser insan ve hayvanlarda sıklıkla karşılaşılan bir problem olmuştur. Kanser hakkında bilinen en eski kayıtlar MÖ 3000 yılına kadar uzanmaktadır. Kanser en kısa tanımıyla, hücrelerin kontrolsüz şekilde çoğalmaları demektir. Anormal şekilde çoğalmaya başlayan bu hücreler bulundukları yerdeki ve hatta uzaklarında bulunan doku ve organları işgal eder ve bu bölgelerde işlevsel bozukluklara yol açarlar. Her ne kadar bazı standartlar belirlenmiş olsa da her kanser türüne özgü olarak farklı yaklaşımlar ve tedaviler uygulanmaktadır. Kanser; beslenme, fiziksel aktivite, obezite, kimyasal radyasyona maruziyet, sigara ve alkol kullanımı gibi yaşamsal ve çevresel etkenleri içeren değiştirilebilir ve/veya genetik yatkınlık, cinsiyet, yaş, etnik köken gibi değiştirilemeyen pek çok faktörün etkisi ile gelişebilmektedir.
KANSERİN DÜNYAMIZDA ETKİLERİ
Gerekli önlemler alınmazsa 2030 yılında yıllık 22 milyon vaka ortaya çıkacak
Kanser günümüzün en önemli sağlık sorunlarından biridir. Sık görülmesi ve ölümcül olması nedeniyle de bir halk sağlığı sorunudur. Dünya Sağlık Örgütü- Uluslararası Kanser Araştırma Ajansı (IARC) 2020 dünya kanser istatistikleri dünya çapında tahmini 19,3 milyon yeni kanser vakası ve yaklaşık 10,0 milyon kanser ölümünün meydana geldiğini göstermektedir. Kansere yakalanan kişi sayısının yıllar içinde gösterdiği artış nedeni ile kansere karşı gerekli önlemler alınmazsa 2030 yılında yıllık 22 milyon, 2040 yılında ise dünya genelinde yaklaşık 28.4 milyon yeni kanser vakasının ortaya çıkacağı öngörülmektedir. Türkiye Kanser İstatistikleri başlıklı çalışma verilerine göre kanser ülkemizde ve dünyada ölüm nedenleri arasında ikinci sırada yer almaktadır. 2017 yılında ülkemizde ise toplam 180 bin 288 kişinin kansere yakalandığı tahmin edildiği belirtilmektedir. Bu nedenle kanser günümüzde en çok çalışılan konular arasında yer almakta ve kanser üzerine yapılan çalışmalar gün geçtikçe artmaktadır. Daha etkin ve daha az yan etkili tedavi arayışı ise çeşitli çalışmalarla devam etmektedir.
KANSER TEDAVİSİNDE KULLANILAN MEVCUT YÖNTEMLER
Kanser tedavisinde kullanılan başlıca mevcut yöntemler; cerrahi işlemler, radyoterapi, kemoterapi, immünoterapi, hormon tedavisi ve lazer tedavisi olarak sıralanabilir. Kanser tedavisinde en sık başvurulan tedavi şekli; tümörün uzaklaştırılmasını sağlayan cerrahi yöntemleri kapsar. Bu, yayılım yapmamış birçok kanser için iyi bir tedavi seçeneğidir. Eğer kanser ilerlemişse ya da çevre dokulara yayılmışsa; cerrahi müdahale, radyoterapi ve kemoterapi birlikte uygulanabilir. Kanser tedavilerinde en önemli sınırlayıcı faktör ilaç direncidir. Klinik olarak, ilaç direnci kemoterapiye maruz kalan tümörlerde ortaya çıkabilmekte ve hastaların çoğunda gelişebilmektedir.
KANSERLE MÜCADELEDE GÜNCEL STRATEJİLER
2000 yılından itibaren Amerikan Gıda ve İlaç Dairesi (FDA, US Food and Drug Administration) tarafından onaylanan yeni antikanser ilaçlar değerlendirildiğinde, büyük kısmını hedefe yönelik ilaçların oluşturduğu görülmektedir. Hedefe yönelik tedaviler, kanserin büyümesine, ilerlemesine ve yayılmasına sebep olan spesifik moleküler hedeflere müdahale ederek etki gösterirler. Bu tür tedavi, kanserli hücredeki değişiklikleri hedef alarak normal hücrelere verilen zararı azaltır ve kanser hücrelerinin gelişimini ve yayılımını önler.
Son dönemlerde umut vadeden tedavi yöntemi ise immünoterapidir. İmmün sistem hücrelerinin; enfekte olmuş, zarar görmüş ve kanserleşmiş hücreleri tanıyabilme yeteneğinden faydalanılarak bu hücrelerin hücre aracılı terapilerde kullanılması hücresel immünoterapinin temelini oluşturur. Hücresel immünoterapinin birçok farklı çeşidi bulunmakla birlikte literatürde en büyük yere sahip olan grubunu T hücre temelli immünoterapiler oluşturmaktadır.
Kanser Tedavisinde ve Tümör Görüntülemesinde Nanoteknolojik Uygulamalar:
Kozmetikten ilaca, boya sanayisinden biyoteknolojiye kadar pek çok sektörde kullanılan nanoteknolojiden kanser tedavisinde de yararlanma çabaları sürmektedir. Dünyada onaylanmış ve deneme aşamasında olan bazı çalışmalarda, nanopartiküller vasıtasıyla kanserli hücreler öldürebilmektedir.
Nanoteknoloji kullanılarak geliştirilen özel taşıyıcı sistemler sayesinde sağlıklı hücrelere etki etmeyen ancak kanser hücrelerini öldüren uygulamalar artık mümkün olabilmektedir.
Kanser nanoteknolojisindeki son gelişmeler hem tümör görüntülemesinde ve hem de kanser tedavisinde araştırmacılara yeni araçlar sağlamaktadır. Bu teknoloji, tümöre özgü ligandlar, antikorlar, antikanser ilaçları ve görüntüleme problemleri dahil olmak üzere aynı anda birden fazla fonksiyonel molekül ile konjuge edilebilen ve onkolojide kullanılabilen nanopartiküllerin geliştirilmesini sağlamıştır. Bu nanopartiküller kanser hücrelerinden daha küçüktürler. Bunlar kolaylıkla kan damarları vasıtasıyla aktarılabilirler ve kanser hücrelerinin hem yüzeyindeki hem de içindeki hedef aldıkları tümöre-özgü proteinler ile etkileşime geçebilirler. Tümör hücrelerini hedef alan nanopartikülleri kullanan ilaç dağıtım sistemleri ile çok daha düşük ilaç dozlarıyla kanser tedavisinde yüksek başarı elde edilebilir. Nanoteknolojideki hızlı gelişmeler sayesinde önümüzdeki yıllarda kanser tedavisinin daha akılcı ve daha etkili bir şekilde yapılabileceği öngörülmektedir.
Kanser Tedavisinde Lenfatik Hedeflendirme
Lenf damarları; insanlarda kanserin yayılım yapmasına olanak sağlayan önemli bir yolaktır. Birçok metastatik kanser türü lenf yollarından geçerek çevre dokulara yayılırlar. Son yıllarda yapılan araştırmalar, kanserde lenfanjiyojenezin rolünün ve lenf damarlarının gelişiminin altında yatan moleküler mekanizmaların anlaşılmasını sağlamıştır. Kanser tedavisinde kullanılmak üzere büyüme faktör reseptörlerini hedeflemek ve kinaz etkisini engellemek için küçük bileşikler kullanılır. Hedeflendirmede yeni hedeflerin, yeni ligantların bulunması, nanotaşıyıcıların özelliklerinin iyileştirilmesi sayesinde, ilacın tümörlü bölgeye daha etkili bir şekilde taşınması ve daha az yan etkiye neden olması amaçlanmaktadır. Lenfatik hedeflendirme, kanserin yayılımını önlemek için son derece önemlidir. Lipitlerin emilim mekanizmalarının ve intestinal bölgenin fizikokimyasal özelliklerinin daha iyi anlaşılması sayesinde lenfatik sisteme hedeflendirmede daha etkili formülasyonların geliştirilmesi mümkün olmuştur. Böylece, kanser tedavisinin daha etkin bir biçimde yürütülmesi için önemli bir adım atılmıştır. Gelecekte bu çalışmaların kanser tedavisinde başarıyı daha da artırması beklenmektedir.
Hedefe Yönelik Kanser Tedavisinde Kullanılan Akıllı İlaçlar: EGFR İnhibitörleri
Çağımızın en ölümcül hastalıklarından olan kanserle baş edebilmek için, tümör hücrelerine karşı seçici olarak hedeflenmiş ilaçlar geliştirilmektedir. Bu alanda, büyük umut vadeden hedeflerden biri Epidermal büyüme faktörü reseptörü (EGFR)’dir. Protein tirozin kinaz reseptörlerinden biri olan EGFR, sadece hücrenin canlılığı için gerekli biyolojik olayları kontrol etmekle kalmaz, aynı zamanda tümör büyümesi ve metastazı için gerekli olan anjiyojeneze de yardımcı olur. Tümör hücrelerinde artan EGFR oranlarının keşfedilmesinin ardından, tümör hücrelerinde EGFR hedefine karşı seçici protein tirozin kinaz inhibitörleri geliştirmek için pek çok çalışma yapılmıştır. Keşfedilen ilk inhibitörlere karşı direnç gelişimi gözlenmesinden dolayı, farklı yapısal özelliklere sahip yeni EGFR tirozin kinaz inhibitörleri geliştirilmiş ve etki şekillerine göre üç kuşağa ayrılmıştır. Moleküler hedeflenmiş bu inhibitörlerle yapılan çalışmalar, heyecan verici sonuçlar ve klinik gelişim ile sonuçlanmıştır.
Kanser İmmünoterapisi
Kanser tedavisinde spesifik yöntemlerden biri olan immünoterapi, bireyin bağışıklık sisteminin belirli kısımlarını kullanarak kanser gibi çeşitli hastalıkları tedavi etmek anlamına gelir. Doğrudan kanser hücrelerini hedef alarak sağlıklı hücrelere zarar vermemesiyle immünoterapiye olan ilgi her geçen gün artmaktadır. İmmünoterapide vücudun kendi hücreleri stimüle edilerek ya da dışarıdan verilen maddelerle immün yanıt oluşturulabilir. 19. Yüzyılın ikinci yarısından günümüze kadar kansere karşı çeşitli immünoterapi yöntemleri, uygulamada kendine yer bulmuştur. Kanserin oluşumu, engellenmesi ve elimine edilmesine yönelik mekanizmaların daha iyi anlaşılmasıyla birlikte tüm immünoterapötik yöntemlerde de gelişmeler yaşanmaktadır. Günümüzde monoklonal antikorlar, adoptif immünoterapi, aşılar, sitokinler ve immün sistemi destekleyici tedaviler bu kapsamda geliştirilmekte ve kansere karşı uygulanmaktadır.
Günümüzde T hücre temelli immünoterapiden faydalanılarak kliniklerde uygulanmakta olan başlıca üç tedavi yöntemi vardır: “Immun Checkpoint Inhibitor” (ICI) (immün kontrol noktası inhibitörü), “Bispesific T Cell Engagers” (BiTEs) (Bispesifik T hücre angajörü) ve modifiye edilmiş T hücreleri. İmmünoterapi alanındaki en umut verici yöntemlerden biri, hedef antijeni spesifik olarak tanıyabilen, hedef kanser hücreleri ortadan kaldıran ve genetik olarak modifiye edilmiş T hücresi ekspresyonu yapan kimerik (farklı kökenleri olan hücrelerin aynı organizmada bulunması durumu) antijen reseptörü (CAR) dür. CAR-T hücre tedavisinin etkinliği 2017’de Amerika Birleşik Devletleri Gıda ve İlaç Dairesi (FDA, USA Food and Drug Administration) tarafından onaylanmasıyla kanıtlanmıştır.
KİŞİYE ÖZGÜ GELİŞTİRİLEN ANTİJEN RESEPTÖRÜ İLE HÜCRE TEDAVİSİ (CAR-T)
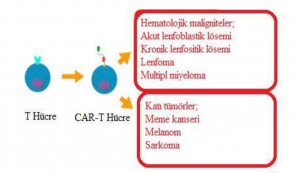
Vücudun kendi bağışıklık sisteminin kullanımı göz önüne alındığında, immünoterapi olarak adlandırılan tedavi; kanseri tedavi etmek için geleneksel tedavilerden daha etkili ve dayanıklı bir tedavi vaat etmektedir. Bir tür immünoterapi olan kimerik antijen reseptörü-T (CAR-T) hücre tedavisi, kanser tedavisinde umut verici yeni bir T hücresi immünoterapisidir. CAR-T; bir antijen tanıma parçası ve T hücresi sinyalleşme alanlarından oluşan bir füzyon proteinidir. CAR-T hücresi, ağırlıklı olarak; akut lenfoblastik lösemi (ALL), kronik lenfositik lösemi (KLL), lenfoma (Lenf kanseri), multipl miyeloma (kemik iliği kanseri) dahil olmak üzere hematolojik kanserlerin tedavisinde kullanılmıştır. CAR-T hücresi; melanom (cilt kanseri), meme kanseri ve sarkom (bağ dokusunda oluşan tümör) gibi tümörlerin tedavisinde ise büyük umut vaat etmektedir.
Güvenlik ve etkinliği artırmak, üretim maliyetlerini azaltmak ve hematolojik kanserlerin ötesinde uygulanabilir kılmak için kimerik antijen reseptörü teknolojisinin iyileştirilmesine yönelik çalışmalar yürütülmekte ve klinik çalışmaların sayısı katlanarak artmaya devam etmektedir. Kişiye özgü T hücreleri elde etme ihtiyacını azaltabilecek yeni T hücreleri kaynakları da araştırılmalıdır. Biyoteknoloji ile ilaç şirketlerinin yoğun ilgisiyle bu gelişim kesinlikle hızlanacaktır. Ayrıca; gelecekte biyoloji ve tıp alanındaki gelişmeler CAR-T hücre tedavisinin çeşitli hastalıklar için güvenilirliğini ve etkinliğini artıracak ve birçok farklı kanser için de iyileştirici bir yöntem olacaktır.
CAR-T Hücrelerinin Üretilip Uygulanması
CAR’lar belirli bir hedef antijeni eksprese eden hücreleri tanımak ve ortadan kaldırmak için lenfositleri, lenfositlerin içerisinden de en yaygın olarak T hücrelerini yeniden yönlendirme işlevi gören, tasarlanmış genetik reseptörlerdir.
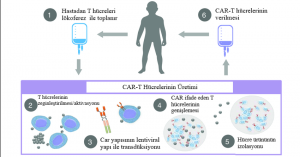
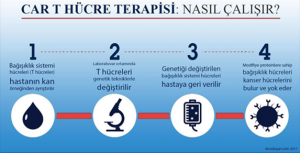
Tedavinin uygulanma sürecini genel hatlarıyla beş adımda inceleyebiliriz:
1) Ayırma: Otolog olarak hastalardan veya allojenik olarak donörlerin periferik kan mononükleer hücresinden (PBMC) lökoferez yöntemiyle toplanan T hücreleri saflaştırılır.
2) Modifikasyon: T hücrelerine in vitro olarak genetik mühendisliği yoluyla tümör hücrelerini tanıması için kimerik antijen reseptörü eksprese edilerek CAR-T hücreleri üretilir.
3) Genişleme: CAR-T hücreleri tedavide kullanılacak yeterli düzeye getirilmek için in vitro olarak gerekli doza kültürlenir.
4) İnfüzyon: CAR-T hücreleri hastalara aşılanır. CAR-T hücrelerinin çoğalmasına engel olmamak adına infüzyondan hemen sonra kısa süreli bir immünosupresif kemoterapi uygulanır. Hastaya aşılanan bu CAR-T hücreleri in vivo olarak tümöre karşı olan etkilerini uygulamak için çoğalmaya başlar.
5) İzleme: tedavinin verebileceği advers reaksiyonlar ve tedavinin etkileri yakından izlenir.
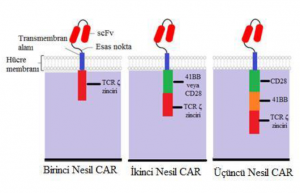
CAR-T yapısının gelişimi dört kuşaktan geçmiştir. Her nesil CAR-T yapısı hücre içi alana daha fazla bileşen eklenerek daha spesifik, verimli ve dayanıklı hale getirilerek değiştirilir.
CAR-T Hücre Tedavisinin Kullanıldığı Hastalıklar
Genellikle hematolojik hastalıklar ve özellikle hematolojik malignitelerde kullanılan CAR-T hücre tedavisi günümüzde direnç geliştirmiş B ALL, B hücreli Lenfoma ve Multipl Myeloma’da umut vadeden ve çalışmaların devam ettiği bir tedavi yöntemidir. CAR-T hücreleri AML gibi hematolojik kanserler daha fazla etkili olmakla birlikte katı tümörlere karşıda etkilidir. CAR-T-hücre tedavisi, akut lenfoblastik lösemili çocuklar ile ileri evre lenfomalı erişkin hastaların tedavisi için, FDA (Amerikan Gıda ve İlaç İdaresi) tarafından onaylanmıştır. CAR-T hücre tedavisinin en aktif kullanıldığı maligniteler B hücre maligniteleridir.
FDA tarafından onaylanan 2 CAR-T hücre tedavisi Kymriah (tisagenlecleucel) ve Yescarta (axicabtagene ciloleucel)’dır. Ağustos 2017 tarihinde onaylanan ilk ilaç olan Kymriah (tisagenlecleucel), 25 yaş ve altı çocuk, genç erişkinlerde refrakter veya nüks eden B hücreli akut lenfoblastik lösemi (ALL)’li hastalar için uygundur. İkinci T hücre immünoterapisi olan Yescarta (axicabtagene ciloleucel) Ekim 2017 tarihinde onaylanmıştır. Yescarta, tekrarlayan veya standart tedavilere cevap vermeyen büyük B hücreli lenfomalı hastalar için onay almıştır
Türkiye’de CAR-T Hücre Tedavisi
Türkiye’de özellikle genetik geçişli olan hastalıklar sık görülmektedir ve kanser de bu hastalıklardan biri olarak sıklıkla karşılaştığımız bir halk sağlığı sorunu olarak değerlendirilmektedir. Kanser tedavisinde kullanılan çeşitli güncel yöntemler uygulanmakla birlikte CAR-T hücre tedavisi de son yıllarda ülkemizde geliştirilip uygulama olanakları sunmaktadır.
Ankara Hematoloji ve Onkoloji Derneği Kurucu Başkanı Prof. Dr. Fevzi Altuntaş, kişiselleştirilmiş CAR-T hücre tedavisinin, Türkiye’de ilk kez klinik araştırma kapsamında Ankara Onkoloji Eğitim ve Araştırma Hastanesinde hematolojik kanserli hastalara uygulanmaya başladığını bildirdi. Ülkemizde bir ilk olarak Multiple Myeloma hastalarında faz çalışmaları kapsamında, CAR-T hücre tedavisini uygulamaya başlandı. Hastalar, kanser hücrelerini daha güçlü bir şekilde yok eden ve yüz binlerce dolara mal olan bu tedaviden, yürütülen klinik araştırma kapsamında ücretsiz yararlanabilmektedir.
Üsküdar Üniversitesi Transgenik Hücre Teknolojileri Merkezi (TRGENMER) CAR-T hücre tedavisi üzerine çeşitli çalışmalarda bulunmaktadır. Çalışmanın 2. aşaması tamamlanmış, 3. aşamasına ise Temmuz ayında geçileceği belirtilmiştir. Bu çalışmaların nihayetinde önümüzdeki yıllarda Türkiye’yi sağlık alanında, kişiselleştirilmiş tedavi ve genetik tedaviler alanında önder ülkelerden biri yapacağı öngörülmektedir.
CAR-T Hücre Tedavisinin Olası Yan Etkileri
CAR-T hücre tedavisi klinik çalışmalarında pozitif sonuçlar elde edilirken, ciddi toksisiteler mümkündür ve yaşamı tehdit edici olabilmektedir. Tüm tedavilerde olduğu gibi, CAR-T hücrelerinin toksisitesi, hedef veya hedef dışı olarak sınıflandırılabilir. CAR-T hücre tedavisinden sonra gözlenebilecek iki önemli akut toksisite bulunmaktadır: Sitokin salınım sendromu (CRS) ve CAR-T hücre ilişkili Ensefalopati Sendromu (CRES) olarak da adlandırılan nörotoksisite.
Sitokin salınım sendromu (SSS): CAR-T tedavisinde görülen en sık toksik yan etkidir. SSS genelde ilk infüzyondan birkaç gün sonra ortaya çıkar. SSS’de görülen hafif semptomlar ateş, halsizlik, baş ağrısı, döküntü, eklem ağrısı ve miyaljidir. Ciddi SSS vakaları taşikardi, hipotansiyon ve yüksek ateş ile karakterizedir. Hafif, orta semptomlar kendini sınırlar ve yakın takip ve destek tedavisi ile üstesinden gelinebilirken bazı hastalarda kötüye gidiş de olabilir.
Nörolojik Toksisite: Lösemide CAR-T tedavisi nörolojik semptomlara neden olabilir. Özellikle CD-19 spesifik CAR-T tedavilerinde nörolojik toksisite daha sık görülmektedir. CAR-T hücre tedavileri komplikasyonlarının doğru yönetilmesi, tedavi başarısında oldukça önemlidir.
Tüm hastaların bazı olası yan etkileri tolere edemeyeceklerini ve bu nedenle, CAR-T hücresi tedavisine başlanmadan önce her hastanın tıbbi ve sağlık durumunun dikkatli bir şekilde değerlendirilmesi gerektiğini belirtmek önemlidir. Yeni nesil CAR-T hücre tedavilerinde hedef bu komplikasyonları en aza indirmeyi ve başarı oranları artırmayı hedeflemektedir.
Sonuç olarak kanser tedavisinde CAR-T Hücre tedavisinin, bu alandaki çalışmalarda meydana gelen yeni gelişmeler ile birlikte ilerleyen dönemde çok daha güvenli ve etkin bir şekilde uygulanabilecek bir yaklaşım olduğu öngörülmektedir.
KAYNAKÇA
- Mohanty, R., Chowdhury, C. R., Arega, S., Sen, P., Ganguly, P., & Ganguly, N. (2019). CAR T cell therapy: A new era for cancer treatment. Oncology reports, 42(6), 2183-2195.
- Özlem, G. Ö. K., & ASLAN, A. (2019). Kişiye Özgü Geliştirilen Antijen Reseptörü ile Hücre Tedavisi (CAR-T). Journal of the Institute of Science and Technology, 9(4), 2235-2245.
- Çevik, Ö., AYDIN, U., & Gürsoy, R. N. (2012). Kanser tedavisinde lenfatik hedeflendirme. Hacettepe University Journal of the Faculty of Pharmacy,.
- Barbaros, M , Di̇kmen, M . (2015). Kanser immünoterapisi . Erciyes Üniversitesi Fen Bilimleri Enstitüsü Fen Bilimleri Dergisi
- Fen Bilimleri Dergisi , 31 (4) , 177-182 . Retrieved from https://dergipark.org.tr/tr/pub/erciyesfen/issue/25543/269496
- Cemre, A. C. A. R., & Altuntaş, T. G. (2019). Hedefe yönelik kanser tedavisinde kullanılan akıllı ilaçlar: EGFR inhibitörleri. Fabad Journal of Pharmaceutical Sciences, 44(1), 47-64.
- Erdoğan, A , Özkan, A . (2013). Kanser Tedavisinde ve Tümör Görüntülemesinde Nanoteknolojik Uygulamalar . Arşiv Kaynak Tarama Dergisi , 22 (3) , 426-440 . Retrieved from https://dergipark.org.tr/tr/pub/aktd/issue/2207/29362
- Dünya Kanser İstatistikleri 2020 – Her 5 kişiden biri kanserle karşılaşıyor https://www.drozdogan.com/dunya-kanser-istatistikleri-2020-her-5-kisiden-biri-kanserle-karsilasiyor/
9. DSÖ Kanser Verileri Tablosu Çevirisi (https://www.losante.com.tr/Content/brosur/DS%C3%96%20Kanser%20Verileri%20Tablo%20%C3%87evirisi.pdf) - Grupp S, 2018. Beginning the CAR T Cell Therapy Revolution in the US and EU. Current Research in Translational Medicine, 66(2): 62-64.
- Hucks G, Rheingold SR, 2019. The Journey to CAR T Cell Therapy: The Pediatric and Young Adult Experience with Relapsed or Refractory BALL. Blood Cancer Journal, 9(10): 1-9.
- Baybutt TR, Flickinger JC, Caparosa EM, Snook AE, 2019. Advances in Chimeric Antigen Receptor T-Cell Therapies for Solid Tumors. Clinical Pharmacology & Therapeutics, 105(1): 71-78
- Brudno JN, Kochenderfer JN, 2019. Recent Advances in CAR T-Cell Toxicity: Mechanisms, Manifestations and Management. Blood Reviews, 34: 45-55.
- Ataca, P., & Arslan, Ö. (2015). Chimeric antigen receptor T cell therapy in hematology. Turkish Journal of Hematology, 32(4), 285.
- Nair R, Neelapu SS, 2018. The Promise of CAR TCell Therapy in Aggressive B-Cell Lymphoma. Best Practice & Research Clinical Haematology, 31: 293–298.
- Wang LL, James ME, Kumbhojkar N, Kapate N, Clegg JR, Prakash S et al. Cell therapies in the clinic. Bioeng Transl Med. 2021;6:e10214
- De Bousser, E., Callewaert, N., & Festjens, N. (2021). T cell engaging immunotherapies, highlighting chimeric antigen receptor (CAR) T cell therapy. Cancers, 13(23), 6067.
- Fischer, J. W., & Bhattarai, N. (2021). CAR-T cell therapy: mechanism, management, and mitigation of inflammatory toxicities. Frontiers in Immunology, 12, 693016.
- Zhang, X., Zhu, L., Zhang, H., Chen, S., & Xiao, Y. (2022). CAR-T cell therapy in hematological malignancies: Current opportunities and challenges. Frontiers in immunology, 13, 927153.
- Medenı, Ş. S., Sevındık, Ö. G., Acar, C., Turkyilmaz, D., & Kaya, S. Y. (2015). Akut Myeloid Lösemi Hastalarımızın Retrospektif Değerlendirilmesi. Retrospective Evaluation Of Patıents With Acute Myeloıd Leukemia. DEU Tıp Fakültesi Dergisi, 29, 65-9.
- Zeynep, A. R. A. L., & ÇAKIR, S. (2023). Kimerik antijen receptorü (CAR-T) hücresi ve tedavide kullanımı. Çukurova Tıp Öğrenci Dergisi, 3(1), 1-5.
- Gardner, R. A., Finney, O., Annesley, C., Brakke, H., Summers, C., Leger, K., … & Jensen, M. C. (2017). Intent-to-treat leukemia remission by CD19 CAR T cells of defined formulation and dose in children and young adults. Blood, The Journal of the American Society of Hematology, 129(25), 3322-3331.

Türk Dünyası Raporu Ağustos 2023
Bunları da beğenebilirsiniz

Türk Dünyası Raporu Ağustos 2023
8 Eylül 2023
AAE- TÜRK DÜNYASI RAPORU-Ağustos-2020
2 Eylül 2020

